
A Ordem dos Farmacêuticos (OF) acompanha o ecossistema regulamentar e legal, e mantém como objetivo a excelência da profissão em defesa do interesse do cidadão. Uma das iniciativas recentes da Direção Nacional (DN) da Ordem dos Farmacêuticos, em 2024, foi a criação de Novos Grupos de Interesse, grupos consultivos e de apoio à DN, sendo que um deles de Avaliação de Tecnologias de Saúde (ATS) e Acesso ao Mercado (AM).
O Acesso ao Mercado foca-se na atividade de garantir que a Tecnologia de Saúde está financiada e disponível no Serviço Nacional de Saúde (SNS). Compreende, a ATS e o envolvimento com as partes interessadas (stakeholders) para a tecnologia de saúde em causa. Tem uma relevante importância, o envolvimento com as associações de doentes, no ouvir as suas preferências e necessidades, bem como na literacia acerca da tecnologia em causa.
A Avaliação de Tecnologias de Saúde e Acesso ao Mercado são atividades paralelas, e interligadas, principalmente para assegurar que os cidadãos podem aceder de modo equitativo à inovação mais recente, mantendo a sustentabilidade do sistema nacional de saúde.
A aprovação de uma Tecnologia de Saúde por parte das Autoridades (designada por Autorização de Introdução no Mercado ou AIM), confirma que a mesma tem evidência suficientemente robusta para demonstrar uma relação benefício-risco favorável. Nesta fase não são avaliados os critérios de custo-efetividade ou eficiência, apenas Eficácia, Segurança e Qualidade.
As decisões de financiamento de Tecnologias de Saúde, nomeadamente medicamentos ou dispositivos médicos, é efetuada quando há demonstração de que a nova tecnologia, traz mais “valor” face ao standard of care. O valor é atualmente materializado em mais valias clínicas ou/e económicas. Portugal tem orientações para a ATS desde 1998, as quais foram atualizadas em julho de 2022[1]. A maioria dos processos são, ainda, relativos a medicamentos. E, a ATS, com consequente financiamento, segue-se à obtenção da AIM .
A nova tecnologia necessita demonstrar benefícios clínicos ou demonstração de pertinência no arsenal terapêutico existente, ter um benefício económico e ter comportabilidade orçamental. A evidência é avaliada sequencialmente pelo Infarmed, conforme esquematizado na sua página[2].
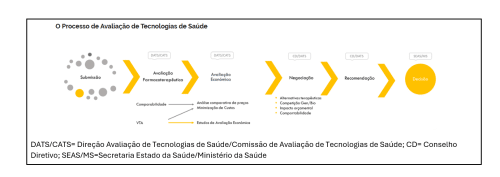
De forma simples, as fases da ATS podem ser descritas como na sequência seguinte:
- Identificação da necessidade a ser satisfeita. Analisa-se se esta necessidade é, mesmo que parcialmente, satisfeita, ou de todo, a nova tecnologia vem dar resposta a uma necessidade sem resposta até à data.
- Definição do PICO (População, Intervenção, Comparador e Resposta/Outcome).
- Evidência científica da nova Tecnologia de Saúde vs. o Standard of Care, demonstrando o seu valor terapêutico equivalente ou acrescentado, ou a relevância para o arsenal terapêutico existente (como por exemplo, uma formulação que reduza o número de tomas diárias).
- Demonstração da vantagem económica, através de estudos de avaliação económica (CE- Custo-Efetividade, CU- Custo-Utilidade, CB -Custo-Benefício), minimização de custos, ou meramente uma redução do custo do tratamento/intervenção (exemplo paradigmático: um medicamento genérico).
- Negociação, que tem como objetivo assegurar um impacto orçamental comportável para o SNS. Nesta fase podem ser estabelecidas condições, espelhadas em contratos, com condições diversas, como por exemplo um limite da despesa anual financiada, acima da qual a empresa pagará o remanescente.
- Aspetos complementares, como a equidade, acesso e aceitabilidade da nova nove tecnologia por parte da pessoa e do profissional de saúde.
- Recomendação para a decisão, por quem avalia, desde os peritos farmacológicos e económicos, bem como pelo Conselho Diretivo do Infarmed.
- Decisão, por parte do Ministério da Saúde.
Portugal é um dos países mais envelhecidos da Europa, e, tendencialmente, é a população mais idosa quem consome mais recursos de saúde, recursos esses que são finitos. Assim, cada vez mais, a demonstração de que uma nova tecnologia cumpre os critérios de eficácia comparativa, eficiência e custo-efetividade, é a base crítica de apoio ao decisor para otimizar a utilização dos recursos disponíveis. Contudo, a decisão final é sempre política.
As ciências da saúde têm evoluído muito e de forma rápida, resultando na aprovação (por exemplo, novas AIMs) de Tecnologias de Saúde que tendem a tardar a estarem acessíveis aos cidadãos por questões do seu financiamento.
Como parte da reforma farmacêutica europeia, baseada nos 3 A: Access, Affordability & Availability, e de acordo com o Regulamento 2021/2282 da CE foi estabelecido o processo de avaliação clínica conjunta (Joint Clinical Assessment) que entrou em vigor em janeiro de 2025. É procedimento obrigatório para produtos de terapias avançadas (ATMPs – Advanced Therapy Medicinal Products) e medicamentos para oncologia, cujo pedido de AIM é avaliado pela EMA. Em 2026, será aplicado a dispositivos médicos de risco elevado selecionados; até 2028 será alargado aos medicamentos orfãos e, a partir de 2030 será aplicável a todos os medicamentos avaliados pela EMA. Posteriormente, alvitro que este procedimento venha a ser possível para todas as outras Tecnologias de Saúde, desde que as empresas o pretendam.
O objetivo é que esta ATS tenha uma avaliação clínica mais rápida e uniforme na UE, se reduza a duplicação de esforços em cada uma das autoridades e requerentes em cada país, haja uma maior e melhor coordenação entre os países, particularmente os mais pequenos e com menos experiência em ATS.
O requerente submete o pedido de avaliação clínica (para fins de seu financiamento) não após a concessão da AIM, mas em paralelo com o pedido de AIM à EMA, e os dois pedidos são avaliados em paralelo[3].
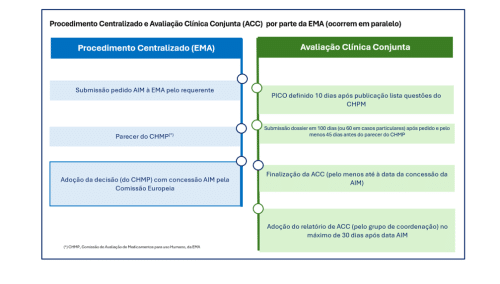
Existe um grupo europeu de coordenação da ATS, com membros das Agências de todos os Estados membro da União Europeia. Será avaliado por peritos de dois ou mais Estados Membro (Assessor e Co-Assessors), que podem consultar doentes, médicos e outros parceiros no decorrer do processo. Este trabalho culminará no respetivo relatório (de eficácia clínica, segurança e efetividade relativa versus o Standard of Care), que será publicado a nível central, e que será utilizado pelas Autoridades Nacionais como base do seu processo de financiamento. A avaliação económica e decisão mantêm-se sempre no foro de cada país.
A Comissão Europeia iniciou o primeiro período de submissão de pedidos para as Consultas Científicas Conjuntas (Joint Scientific Consultations – JSC), no quadro do Regulamento Europeu de Avaliação de Tecnologias de Saúde (HTAR). As Consultas Científicas Conjuntas têm como objetivo proporcionar uma plataforma de diálogo entre as empresas farmacêuticas e de dispositivos médicos com as agências e organismos responsáveis pela avaliação de tecnologias de saúde, para que essas entidades obtenham orientações e recomendações sobre dados científicos, análises e processos no âmbito dos estudos clínicos que sustentam a avaliação clínica conjunta dos medicamentos e dispositivos médicos[4].
De destacar, sem ser de somenos importância, e como sinal do reconhecimento do seu mérito, que o Dr. Rui dos Santos Ivo, além de Presidente do Board da EMA, é o Presidente do HGA – Grupo de Chefes das Agências de Avaliação de Tecnologias de Saúde. O INFARMED, I.P. desempenhou um papel essencial na construção deste novo sistema, participando na Rede Europeia de Avaliação de Tecnologias de Saúde (EUnetHTA) que esteve na base da sua criação. A ação do Infarmed foi decisiva no acordo que levou à aprovação do regulamento e que ocorreu durante a Presidência Portuguesa da União Europeia, em 2021. Hoje mantém essa ativa participação enquanto membro do Grupo de Coordenação de Tecnologias de Saúde (HTACG) onde também é co-chair do Subgrupo de Metodologias de Avaliação e, igualmente, como chair do grupo HAG – Heads of HTA Agencies.
A curto-médio prazo, até que este processo esteja bem gizado, haverá questões importantes a resolver, como por exemplo a definição do standard of care europeu, para o PICO europeu. Teremos, assim, no entretanto, vários PICOs, situação que pode trazer uma complexidade acrescida para os requerentes e autoridades.
Portugal com o quadro legislativo de ATS com décadas, espera-se mais bem preparado no acompanhar e adotar o novo quadro legislativo europeu.
Em Portugal, são na maioria farmacêuticos quem está a liderar os departamentos de ATS e AM, nas empresas e no Infarmed. Esta situação é uma responsabilidade acrescida que os farmacêuticos abraçam, e desempenham com primor. Obviamente, que o trabalho é muldisciplinar, com o envolvimento de outros profissionais, mas demonstra que os farmacêuticos adquiriram formação adicional à sua formação pré-graduada, e que também nesta vertente servem o cidadão.
Fernanda Aleixo
Coordenadora do Grupo de Interesse em Avaliação de Tecnologias de Saúde e Acesso ao Mercado da Ordem dos Farmacêuticos
[1] Deliberação nº 76/CD/2022 do Infarmed, https://www.infarmed.pt/documents/15786/1963929/Deliberação+Nº76_CD_2022+de+29+de+julho/feaa4c05-b564-a25e-0ccb-526eb854ac7b , acedida em maio 2025
[2] https://www.infarmed.pt/web/infarmed/entidades/medicamentos-uso-humano/avaliacao-tecnologias-de-saude, acedido em maio 2025
[3] Informação da EMA, Implementing the EU Health Technology Assessment Regulation, acedido em maio.2025
[4] Nota da página do Infarmed, https://www.infarmed.pt/web/infarmed/infarmed?p_p_id=101&p_p_lifecycle=0&p_p_state=maximized&p_p_mode=view&_101_struts_action=%2Fasset_publisher%2Fview_content&_101_returnToFullPageURL=%2Fweb%2Finfarmed&_101_assetEntryId=10898532&_101_type=content&_101_urlTitle=avaliacao-das-tecnologias-de-saude-comissao-europeia-abre-periodo-de-submissao-de-pedidos-para-consultas-cientificas-conjuntas&inheritRedirect=false&redirect=https%3A%2F%2Fwww.infarmed.pt%2Fweb%2Finfarmed%2Finfarmed%3Fp_p_id%3D3%26p_p_lifecycle%3D0%26p_p_state%3Dmaximized%26p_p_mode%3Dview%26_3_redirect%3D%252Fweb%252Finfarmed%26_3_keywords%3Davalia%25C3%25A7%25C3%25A3o%2Bclinica%2Bconjunta%26_3_groupId%3D15786%26_3_struts_action%3D%252Fsearch%252Fsearch, acedido em maio 2025






